Evaristo SA / AFP
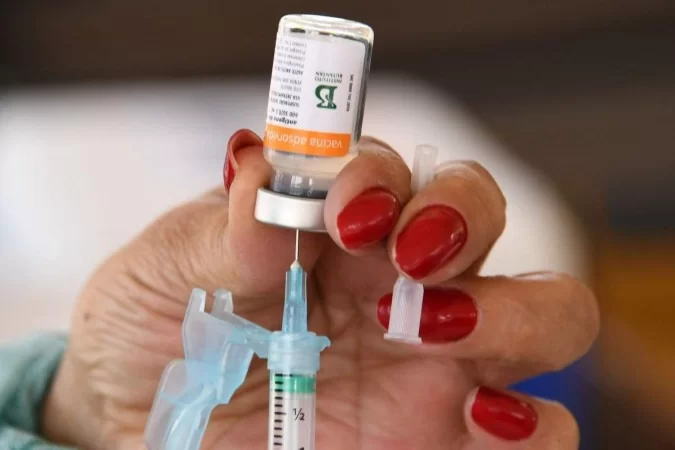
Um ano e meio após a aprovação do uso emergencial, a Agência Nacional de Vigilância Sanitária (Anvisa) recebeu o pedido de registro definitivo da vacina CoronaVac contra a covid-19. A solicitação foi enviada pelo Instituto Butantan ao órgão regulador na sexta-feira passada e, ontem, a autarquia divulgou a informação.
As áreas técnicas da Anvisa devem analisar o registro definitivo da CoronaVac em até 60 dias. O imunizante — resultado da parceria entre o instituto ligado ao governo de São Paulo com a chinesa Sinovac — foi o primeiro a ser aprovado no Brasil e está em uso desde 17 de janeiro de 2021, para adultos, sob autorização emergencial. Em 2022, recebeu a autorização para ser aplicado em crianças e adolescentes de 6 a 17 anos.
Como as demais vacinas contra a covid-19, o pedido terá análise prioritária, conforme firmado pela Resolução da Diretoria Colegiada (RDC). Além da tramitação acelerada, a norma prevê a possibilidade de assinatura de termos de compromisso.
A CoronaVac é a única vacina contra a covid-19 que ainda não tem um registro definitivo no Brasil. O gerente-geral de produtos biológicos da Anvisa, Gustavo Mendes, explicou que o fato de a vacina ser registrada faz com que ela possa ser disponibilizada de forma permanente, independentemente da situação do uso emergencial. "Isso significa que o fabricante pode disponibilizar essa vacina, também na iniciativa privada, ou mesmo nos programas de saúde pública, enquanto o registro estiver válido", disse.
Segundo Mendes, a avaliação vai ter como foco todos os dados gerados até o momento sobre desenvolvimento, da formulação, produção e estudos que estão sendo produzidos sobre eficácia e segurança da vacina. "O foco é uma avaliação completa, porque o objetivo é que essa vacina seja utilizada de forma permanente caso o registro seja aprovado", frisou.
Para o infectologista Julival Ribeiro, membro da Sociedade Brasileira de Infectologia, o registro também afasta qualquer dúvida sobre a segurança e eficácia da CoronaVac. "Porém, no momento em que foi aprovada a vacina para uso emergencial, foi mostrada a eficácia e segurança da vacina", observou.
A análise de vacinas pela Anvisa é feita de forma conjunta, por três áreas distintas: a área de Medicamentos, que avalia os aspectos de segurança e eficácia; a área de Farmacovigilância, responsável pelo monitoramento e planos de acompanhamento da vacina; e a área de Inspeção e Fiscalização, responsável pela avaliação das Boas Práticas de Fabricação.
Queda de braço
O início do uso da CoronaVac no Brasil foi recheado de polêmicas. Em janeiro de 2021, o então governador de São Paulo João Doria (PSDB), anunciou que iniciaria a vacinação da população contra o novo coronavírus naquela época — o comunicado foi feito antes mesmo de o governo federal lançar a versão final do plano de imunização nacional. A medida fez o Palácio do Planalto chamar a medida de "populismo barato e irresponsável".
Após Doria anunciar o início da fabricação da CoronVac, em outubro de 2020, o presidente Jair Bolsonaro (PL) disse que não compraria a vacina por ser ela desenvolvida em parceria com chineses, mas, semanas depois, o chefe do Executivo recuou e disse que poderia comprar a CoronaVac. Aliás, o presidente resistiu o quanto pôde para não comprar vacinas e insistia que o melhor remédio era cloroquina, oferecida até para as emas do Palácio do Alvorada.
Um exemplo disso foi a declaração do presidente regional da Pfizer na América Latina, Carlos Murillo, que, em audiência na Comissão Parlamentar de Inquérito (CPI), disse que fez contatos com o governo brasileiro para apresentação do imunizante entre maio e junho de 2020. Ele também afirmou que a empresa chegou a oferecer, na segunda e na terceira propostas apresentadas ao Ministério da Saúde, em agosto de 2020, 1,5 milhão de doses para serem entregues ainda em 2020, mas isso não ocorreu porque o governo brasileiro não respondeu às tentativas de contato da companhia.
A CoronaVac foi o primeiro imunizante permitido no Brasil contra a covid-19 e passou a ser usado em janeiro de 2021 e, graças a essa vacina, muitas mortes foram evitadas. Segundo o Butantan, 110 milhões de doses foram entregues ao Ministério da Saúde desde então. Na próxima quarta-feira (13), em reunião extraordinária do Conselho Diretor, a Anvisa discutirá a ampliação do uso da vacina CoronaVac em crianças de 3 a 5 anos.
Por: Correio Braziliense










0 Comentários
Facebook.com/akiagoraEventos